36氪獲悉,標新生物醫藥科技(上海)有限公司(GluetacsTherapeutics,以下簡稱:標新生物)完成了Pre-A輪融資,融資金額逾億元人民幣,本輪融資由沂景資本領投,倚鋒資本和約印醫療基金跟投。此前,標新生物曾獲得由普恩國新領投,磐谷創投、勝輝資本和動平衡資本跟投的天使輪投資。
本輪融資將用于其核心項目GT919臨床I期研究,以及腫瘤、自身免疫疾病等項目的臨床申報研究和后續管線的開發。
標新生物成立于2020年,由上海科技大學免疫化學研究所原執行所長姜標課題組孵化,是一家專注開發口服抗腫瘤和自身免疫疾病領域潛在"first-in-class"或"best-in-class"蛋白降解藥物的新藥研發公司。
目前,標新生產品線包含分子膠(molecularglue)和蛋白降解靶向嵌合體(proteolysis targeting chimera)兩大領域,現擁有靶向蛋白降解藥物技術平臺GLUETACS?,能將藥物化學與人工智能、DNA編碼化合物庫技術結合,專注于開發可口服,靶向不可成藥靶點,或針對耐藥突變和難治疾病領域的可滿足重大未滿足臨床需求的藥物。
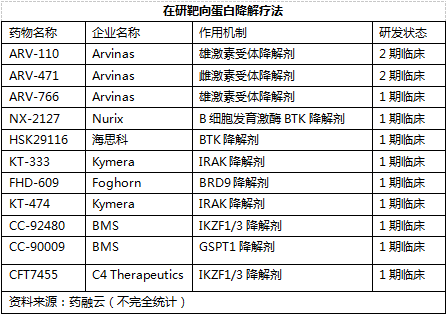
據悉,靶向蛋白降解(TargetedProteinDegradation)是繼蛋白激酶抑制劑和單克隆抗體之后藥物研發領域又一熱門研發方向,通過利用泛素-蛋白酶體系統使用小分子來誘導目標蛋白質的降解。目前,蛋白降解藥物主要有兩類:一類是PROTAC(即蛋白降解靶向嵌合體),通過泛素-蛋白酶體途徑特異性地降解靶蛋白;另一類是分子膠(MG),通過修飾泛素化連接酶表面,從而識別并降解全新底物。
靶向蛋白降解技術只需催化活性、無需高親和力的結合口袋等特點,使得其可以靶向多種不可成藥靶點并克服小分子藥物的多種耐藥性,而且得以在較低劑量發揮作用,從而使該技術成為近年來小分子新藥研發市場的寵兒。目前,全球還未有任何靶向蛋白降解療法獲批問世,不過已有多款藥物進入臨床試驗階段。
資料來源:藥融云
分子膠則是誘導、穩定或增強E3泛素連接酶和新底物(neosubstrates)之間相互作用的小分子化合物,可以導致新底物的降解。免疫調節性酰亞胺藥物(IMiDs)是研究最為廣泛深入的一類分子膠,通過結合CRBN泛素連接酶,為新底物的泛素化降解創造了新的接觸界面,可以誘導泛素化降解IKZF1、IKZF3、CK1α、GSPT1等多達13種已報導的新底物。
據悉,基于GLUETACS?平臺,標新生物開發出了一系列分子膠,是一種新型CRBNE3連接酶調節劑(CELMoDs),使傳統方法無法成藥的靶點成為可能,將疾病相關底物蛋白在胞內進行降解,通過獨特的機制降解多元化的底物。
目前,標新生物的核心項目靶向IKZF1/3的針對復發/難治多發性骨髓瘤的分子膠GT919已經接近完成IND申報研究,預計將在2022年進入臨床研究。GT929同樣靶向IKZF1/3靶點,在彌漫大B細胞淋巴瘤動物模型中顯示了極佳的效果。GT939是一個IKZF2降解劑,在多種實體瘤中有巨大潛力。
多發性骨髓瘤是一種惡性血液系統疾病,表現為克隆漿細胞異常增殖,是血液系統第二大常見惡性腫瘤,中國發病率約1.6/10萬,危及老年群體健康。
目前臨床一線推薦使用來那度胺或沙利度胺等藥物進行誘導治療,隨后可選擇來那度胺、硼替佐米、伊沙佐米、沙利度胺等進行維持治療;
而對于復發的多發性骨髓瘤,目前臨床上采用3-4種一線用藥聯合化療為主,尚無能夠真正延長患者生存期的藥物。
近年還涌現了其他類型治療藥物,大致可以分為HDAC抑制劑、單克隆抗體類藥物、抗體(肽)偶聯藥物、CAR-T療法等。
標新生物的臨床前研究顯示,GT919僅需催化活性即可產生迅速、強效且持久的底物降解,對CRBN親和力極高,從而可以克服傳統免疫調節性酰亞胺藥物的耐藥性,成藥性和口服利用度優異。
目前,標新生物已經獲得多個可口服臨床前候選化合物,在高選擇性靶向目標蛋白外,還兼具免疫調節功能,不但口服活性優異,還可以極大擴展治療領域。
圖片來源:IC Photo
根據Datamonitor Healthcare預測,全球主要國家(美國、日本、法國、德國、意大利、西班牙、英國等七個國家)多發性骨髓瘤單病種主流藥物規模合計約120億美元,未來3-5年保持5-8%的平穩增長。國內方面,至2024年估計市場規模將達到人民幣186億元。
在如此龐大的市場規模的背景下,針對多發性骨髓瘤的新藥開發項目也是不勝枚舉。據悉,安進、再生元及楊森旗下均有藥物目前處于臨床階段。
團隊方面,董事長兼首席執行官楊小寶博士是蛋白降解劑設計和藥物化學的資深專家,曾在跨國藥企、國內制藥企業和國內外頂尖實驗室工作,具有豐富的小分子蛋白降解劑開發經驗。

















 /
/